우리가 일상생활에서 쉽게 접할 수 있는 물에 전류를 흘려주면 수소와 산소로 분해되는데, 이때 생성되는 수소와 산소는 더 이상 다른 물질로 분해되지 않는다. 수소와 산소처럼 더 이상 분해되지 않으면서 물질을 이루는 기본 성분을 원소라고 한다. 지금까지 밝혀진 원소는 118 가지이다. 이 중 90여 가지는 자연에서 발견된 것 이고, 30여 가지는 인공적으로 만든 것이다. 원소는 종류에 따라 성질이 다르며, 우리는 원소의 다양한 성질을 일상생활에 이용한다.

물질을 이루는 기본 성분, 원소
그렇다면 원소의 특징에는 어떤것들이 있을까? 금속 원소가 들어 있는 물질에 불을 붙이면 물질에 포함된 금속 원소의 종류에 따라 특유의 불꽃색이 나타나는데, 이를 금속 원소의 불꽃 반응이라고 한다. 또한 빛을 분광기에 통과시키면 여러 가지 색의 띠가 나타나는데, 이를 스펙트럼이라고 한다. 스펙트럼에는 햇빛을 분광기로 관찰할 때 나타나는 연속 스펙트럼과 금속원소의 불꽃을 분광기로 관찰할 때 나타나는 선 스펙트럼이 있다. 연속 스펙트럼은 무지개와 같은 연속적인 색의 띠가 나타나며, 선 스펙트럼은 몇 개의 밝은 선이 나타나고 다른 부분은 어둡게 나타난다. 선 스펙트럼을 이용하면 리튬과 스트론튬처럼 불꽃색이 비슷한 원소를 구별할 수 있다. 원소의 종류에 따라 스펙트럼에 나타나는 선의 위치, 색깔, 굵기, 개수 등이 다르기 때문이다. 또한 물질에 여러 가지 원소가 들어 있는 경우, 각 원소의 선 스펙트럼이 모두 나타나므로 물질에 포함된 원소의 종류를 확인할 수 있다.

물질을 이루는 기본 입자, 원자
물질을 계속 쪼개면 더 이상 쪼갤 수 없는 입자에 도달한다는 데모크리토스의 생각은 1803 년 돌턴에 의해 ‘모든 물질은 더 이상 쪼개지지 않는 입자, 즉 원자로 이루어져 있다.’는 원자설로 발전하였다. 그 후 여러 과학자의 연구로 원자의 존재가확인되었고, 원자 속에는 원자보다 더 작은 입자들이 존재한다는 것이 밝혀졌다. 원자는 (+)전하를 띠는 원자핵과 (-)전하를 띠는 전자로 이루어져 있다. 원자핵은 원자의 중심에 아주 작은 공간을 차지하고 있으며, 원자 전체 질량의 대부분을 차지한다. 전자는 원자핵 주위에서 끊임없이 움직이고 있다. 원자는 종류에 따라 원자핵의 (+)전하량이 다르며, 한 원자에서 원자핵의 (+)전하량과 전자의 (-)전하량이 같으므로 전기적으로 중성이다. 원자 중 크기가 가장 작은 수소 원자의 지름은 약 100억분의 1 m이고, 수소 원자핵의 지름은 수소 원자 지름의 약 10만분의 1이다. 이처럼 원자는 매우 작아서 눈으로 볼 수 없기 때문에 모형을 사용하여 나타낸다.

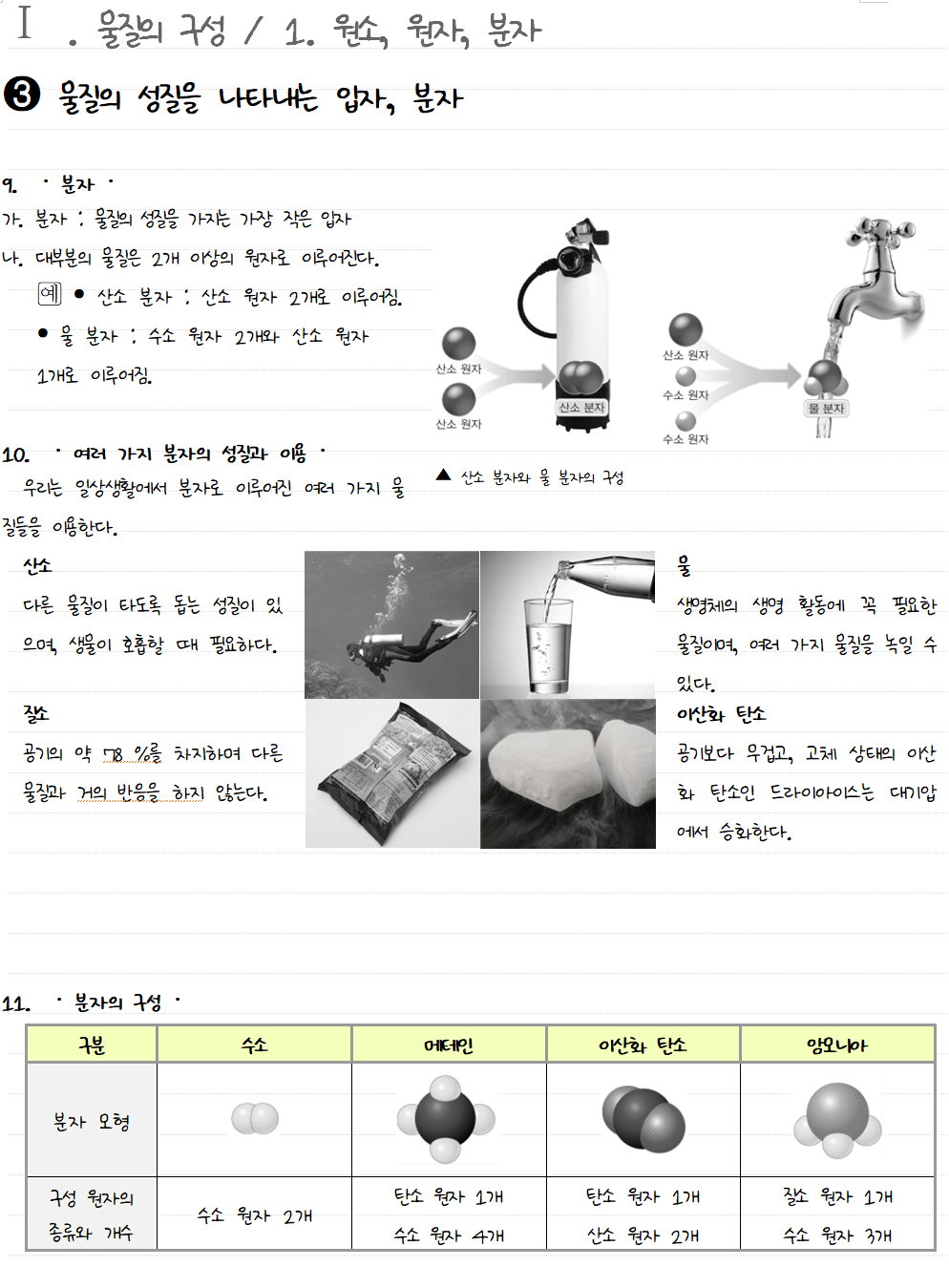
물질의 성질을 나타내는 입자, 분자
산소 기체는 2 개의 산소 원자가 결합한 상태로 존재한다. 이처럼 2개 이상의 원자가 결합하면 분자라는 새로운 물질이 만들어진다. 산소 기체는 다른 물질이 잘타게 도와주는 성질이 있는데, 산소 분자가 산소 원자로 나누어지면 산소 기체의 성질을 잃는다. 즉, 분자는 독립된 입자로 존재하여 물질의 성질을 나타내는 가장 작은 입자이다. 분자는 질소, 암모니아와 같이 몇 개의 원자가 결합하여 이루어진 것도 있고, 원자 1 개로 이루어진 것도 있다. 일산화 탄소 분자와 이산화 탄소 분자는 모두 탄소 원자와 산소 원자로 이루어져 있지만, 성질은 전혀 다르다. 이처럼 같은 종류의 원자로 이루어진 분자라도 그 분자를 이루는 원자의 개수가 다르면 서로 다른 분자이고, 성질도 다르다.
원소와 분자를 기호로 표현하기
중세 시대의 연금술사들은 그때까지 알려진 원소들을 자신만의 독특한 그림으로 표현하였고, 돌턴은 원 안에 알파벳과 그림을 넣어 당시까지 밝혀진 원소를 표현하였다. 과학이 발전함에 따라 발견된 원소의 종류가 점차 많아졌고, 많은 원소를 그림으로 나타내기 어려워졌다. 1813 년 베르셀리우스는 알파벳으로 원소를 나타내는 원소 기호를 만들었다. 현재의 원소 기호는 다음과 같은 규칙에 따라 나타낸다.
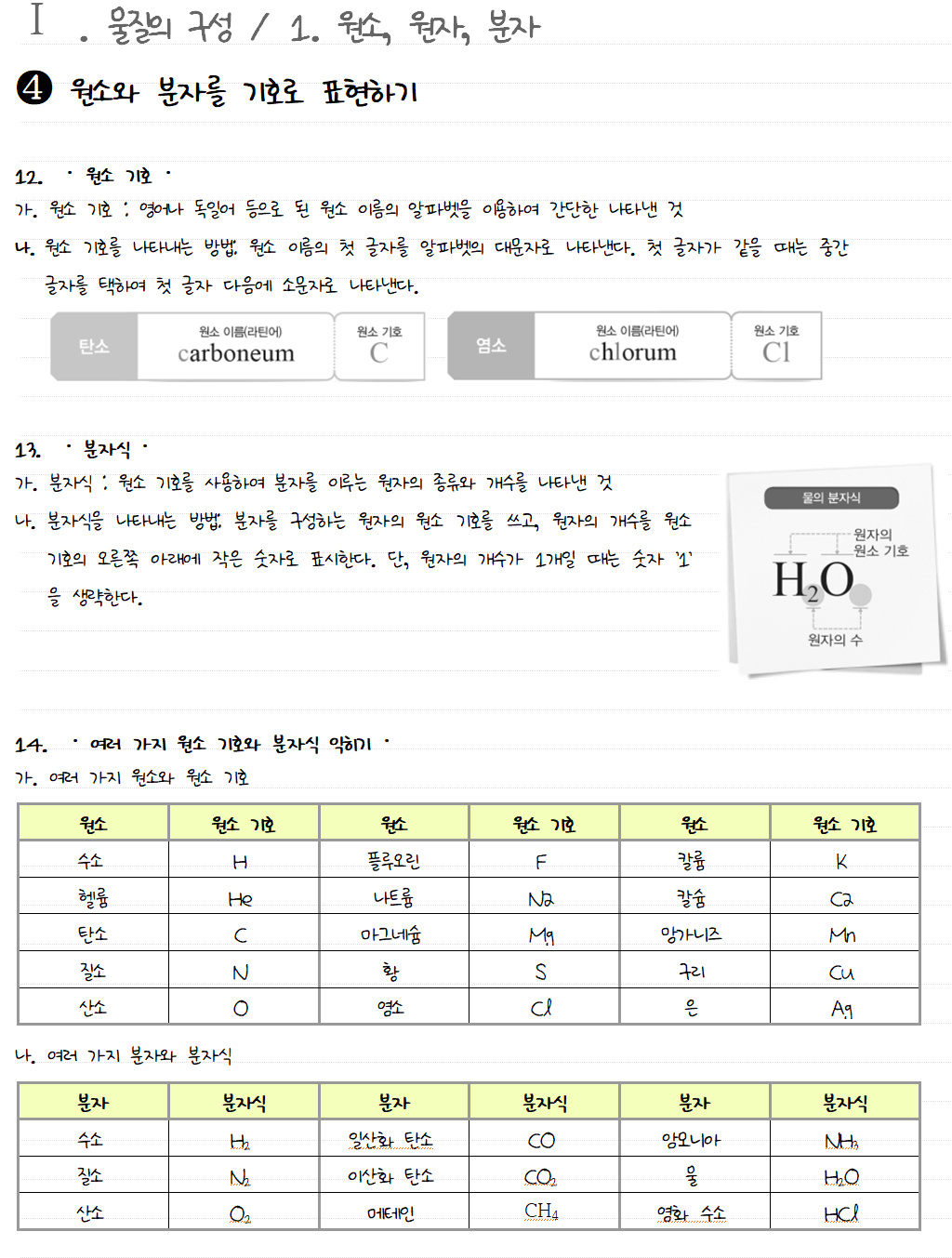
원소를 원소 기호로 나타낼 수 있는 것처럼 원자들이 결합하여 만들어진 다양한 물질도 원소 기호를 이용하여 나타낼 수 있다. 분자는 그 분자를 이루고 있는 원자의 원소 기호와 개수를 이용하여 나타낸다. 산소는 산소 원자 2 개가 결합한 산소 분자로 존재한다. 산소와 같이 한 종류의 원자로 이루어진 물질은 구성 원자의 원소 기호와 결합한 원자의 개수로 나타낸다. 수소 원자 2 개와 산소 원자 1 개로 이루어진 물 분자는 수소 원자와 산소 원자의 원소 기호와 각각의 개수로 나타낸다. 구리나 염화 나트륨처럼 독립된 분자를 이루지 않고 입자들이 연속해서 규칙적으로 배열되어 있는 물질은 원자의 개수를 정해서 나타낼 수 없다.
'중학교 2학년' 카테고리의 다른 글
| [중학교 2학년/ 과학2] 전기와 자기/ 빈 칸 채우기 (0) | 2023.04.18 |
|---|---|
| [중학교 2학년/ 과학2] 물질의 구성/ 빈 칸 채우기 (0) | 2023.04.16 |
| [중학교 2학년/과학2] 자기/ 핵심정리/ 요약 (0) | 2023.03.27 |
| [중학교 2학년/ 과학2] 전기/ 핵심정리/ 요약 (0) | 2023.03.26 |
| [중학교 2학년/ 과학2] 물질의 구성/ 이온 / 핵심정리 / 요약 / (0) | 2023.03.12 |